| Entropie ist ein Begriff, den Rudolf Clausius 1865 einführte und der Inhalt des zweiten Hauptsatzes der Thermodynamik ist: In einem Gas oder einer Flüssigkeit sei die Entropie S (in der Einheit Joule pro Grad Kelvin [J/K]) ein Maß für die molekulare Unordnung: |
||
| •• | Wir legen in eine Kiste links weiße Kugeln, rechts rote Kugeln. Durch Schütteln geht die Ordnung verloren. Je mehr Kugeln am Experiment beteiligt sind, desto unwahrscheinlicher wird die Wiederherstellung der Ausgangsanordnung. Ist das System groß genug, kann Ordnung nur verloren gehen. Der Verlust von Ordnung (= Entropiezunahme) ist irreversibel. Veränderungen in der materiellen Welt zielen darum immer und überall nur in eine einzige Richtung: hin zu Zerfall, Unordnung und Energieentwertung.
|
|
| •• |
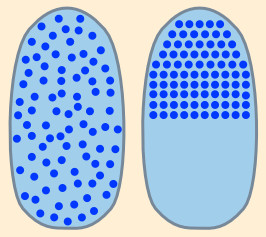 Ein weiteres Beispiel: Wie wahrscheinlich ist es, dass sich Tinte, die man in eine Wanne klaren Wassers gießt, von selbst in einer Hälfte der Badewanne versammelt (Bild rechts)? Ist es nicht eher zu erwarten, dass sich die Tinte in der ganzen Wanne verteilt – lange Zeiträume verausgesetzt? Der Entropiesatz und alle Erfahrung sagt: Die Tinte wird sich verteilen.
Ein weiteres Beispiel: Wie wahrscheinlich ist es, dass sich Tinte, die man in eine Wanne klaren Wassers gießt, von selbst in einer Hälfte der Badewanne versammelt (Bild rechts)? Ist es nicht eher zu erwarten, dass sich die Tinte in der ganzen Wanne verteilt – lange Zeiträume verausgesetzt? Der Entropiesatz und alle Erfahrung sagt: Die Tinte wird sich verteilen.Noch ein Beispiel: Ist es möglich, dass sich Moleküle irgendwo auf der Welt von alleine so versammeln, dass ein Hochhaus entsteht? Es mag möglich sein, dass zufällig ein paar Sandkörner miteinander verkleben, aber man kann nicht erwarten, dass sich viele verklebte Sandkörner dann zu stabilen vertikalen Gebilden aufschichten und sich zusätzlich noch Kupferrohre und Fenster formen. Wer insistiert, dass ein Hochhaus von alleine entstehen kann, hat einen Glauben, der der Vernunft widerspricht. Die Evolutionstheorie ist vergleichbar mit solchem Glauben, dass ein Hochhaus von alleine entsteht. Der Entropiesatz hingegen sagt: Hochhäuser können und werden immer nur zerfallen – lange Zeiträume vorausgesetzt. |
|
| •• | Genauso wie das Entropieprinzip die Richtung aller Veränderungen in der unbelebten Welt vorgibt, genauso unabänderlich fließt ein Bach bergab.
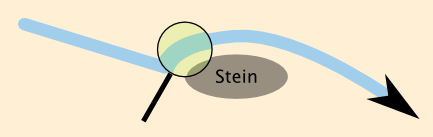 Liegt dem Wasser ein Stein im Weg, ein Stein, der mit seiner Oberseite aus dem Wasser herausragt, kann es sein, dass er bei ausreichend schneller Bewegung des Wassers dennoch überströmt wird. Evolutions-Enthusiasten entdecken unter der Lupe sofort ein Beispiel für einen lokalen Aufwärtstrend (Analogon einer Entropieabnahme). Vergrößert man aber den betrachteten Ausschnitt, wird offensichtlich, dass jede kleine lokale Verwirbelung zwingend dem großen Fließtrend folgen muss, der abwärts führt (Analogon einer Entropiezunahme). Ganz wichtig: Man muss das geschlossene System immer erst korrekt definieren. Aber dann gilt der 2. Hauptsatz für das geschlossene System – für jedes – so sicher wie ein Gesetz.
Liegt dem Wasser ein Stein im Weg, ein Stein, der mit seiner Oberseite aus dem Wasser herausragt, kann es sein, dass er bei ausreichend schneller Bewegung des Wassers dennoch überströmt wird. Evolutions-Enthusiasten entdecken unter der Lupe sofort ein Beispiel für einen lokalen Aufwärtstrend (Analogon einer Entropieabnahme). Vergrößert man aber den betrachteten Ausschnitt, wird offensichtlich, dass jede kleine lokale Verwirbelung zwingend dem großen Fließtrend folgen muss, der abwärts führt (Analogon einer Entropiezunahme). Ganz wichtig: Man muss das geschlossene System immer erst korrekt definieren. Aber dann gilt der 2. Hauptsatz für das geschlossene System – für jedes – so sicher wie ein Gesetz. |
|
| •• | Ein Standardeinwand lautet: „Der Entropiesatz gilt ja nur für geschlossene Systeme, die Erde ist aber kein geschlossenes System, weil die Sonne Strahlungsenergie zuführt.“ Das Argument ist irreführend, denn die Sonnenstrahlung erhöht die Randomisierung auf der Erde. Entropie manifestiert sich überall, auch in offenen Systemen, thermodynamisch z. B. nach der Formulierung dS ≥ dQ ⁄ TdS symbolisiert die Zunahme an Entropie, wenn die Wärmemenge dQ zugeführt wird. T ist die (konstante) Temperatur. Nur bei dS > dQ ⁄ T ist tatsächlich auch eine Arbeitsleistung möglich.. Jedoch lassen sich in offenen Systemen nicht die aufeinander bezogenen Mengen von z. B. dS und dQ bestimmen. Gibt es darum lokal eine Entropieabnahme, muss man den betrachteten Ausschnitt vergrößern, um die Gesamtentropiezunahme zu erfassen. An einer korrekten Systemdefinition sollte es aber nicht fehlen: Statt der Erde könnte man leicht unser Sonnensystem zum geschlossenen System erklären. |
|
| •• | Bei allen Energieumwandlungen wird Arbeit verrichtet und dabei entsteht Entropie (wenn man Entropie hier einmal als eine mengenartige Größe auffassen will). Ein von selbst ablaufender Energieumwandlungsvorgang ist irreversibel; er kann nicht von selbst in umgekehrter Richtung ablaufen, um den ersten Zustand wiederherzustellen. Darum kann Entropie immer nur zunehmen und niemals abnehmen.
|
|
| •• | Entropie spezifiziert den Grad der Unordnung nicht nur in Gasen oder Flüssigkeiten, sondern ganz allgemein in komplexen Systemen. Information ist eine systemgebundene intendierte Ordnung. Für den Zusammenhang zwischen Information und Entropie gilt darum: Entropiezunahme ist direkt proportional zu einem Informationsverlust. Die Selbstentstehung von Information (z. B. für die Biogenese) ist darum unmöglich und käme der Existenz eines perpetuum mobile gleich. Genetische Mutationen sind spontane Zustandsänderungen an einem komplexen System. Der 2. Hauptsatz der Thermodynamik fordert, dass in Summe Mutationen zu einem Informationsverlust führen müssen. Auf der Seite Mutation + Selektion wird genau das dokumentiert und bestätigt. |
|
➤ Abstecher: Urmeer und Massenwirkungsgesetz |
||
| ➤ weiter zum Abschnitt Mikroevolution |